Tingkat keasaman air murni = 7. Kenapa ?
- Galih Tridarna Poetra

- 5 Mei 2019
- 1 menit membaca
Pastinya sudah menjadi hal yang umum ketika mempelajari ilmu kimia, kita diberikan informasi bahwa pH air murni (di suhu 25 °C) adalah 7.0 atau netral. Bagaimana bisa nilai 7.0 tersebut didapatkan?

Pertama-tama, kita harus mengingat kembali bagaimana teori kesetimbangan kimia. Pada suhu 25 °C, diketahui dari 10⁹ hanya ada dua molekul air murni yang terionisasi.
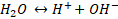
Persamaan reaksi tersebut kemudian dapat dibuat persamaan konstanta kesetimbangannya sebagai berikut :
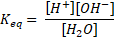
... (01)
Pada suhu 25 °C,konsentrasi molekul air (dalam air. Iya betul, dalam air) dapat dihitung dengan persamaan (diketahui, massa air 1000 gram dalam volume 1.00 liter) :

... (02)
dan disubstitusikan ke dalam persamaan kesetimbangan (01) menjadi :

... (03)
Nilai Keq ditentukan dari pengukuran konduktivitas elektrik air murni dan didapatkan nilai 1.8 x 10⁻¹⁶ M pada suhu 25 °C, sedangkan Kw adalah tetapan/konstanta ionisasi air. Nilai Kw kemudian ditetapkan dengan mensubstitusikan nilai Keq ke dalam persamaan hingga menjadi :

Nilai Kw tersebut juga memiliki makna bahwa pada suhu 25 °C, nilai [H⁺][OH⁻] akan selalu bernilai 1 x 10⁻¹⁴ M². Ketika jumlah H⁺ = OH⁻ dalam suatu larutan, maka larutan tersebut dikatakan sebagai larutan yang memiliki pH netral. Pada titik pH tersebut, konsentrasi H⁺ dan OH⁻ dapat dihitung dari persamaan Kw sebelumnya.

References :
Nelson DL, Cox MM. 2017. Lehninger: Principles of Biochemistry Seventh Edition. New York (US) : WH Freeman Macmillan Learning
Komentar